Концепции современного естествознанияСтраница 3
В 1960- 1970 гг. появился следующий, более высокий, уровень химических знаний - эволюционная химия. В основе ее лежит принцип самоорганизации химических систем, т. е. принцип применения химического опыта высокоорганизованной живой природы.
Молекула – наименьшая структурная единица химического соединения, обладающая его главными химическими свойствами. Молекулы простых веществ состоят из одинаковых атомов, сложных – из разных атомов. Инертные газы (гелий, неон, аргон, криптон, ксенон, радон) находятся в одноатомном состоянии. Существует большое количество соединений, молекулы которых состоят из многих тысяч атомов (искусственные полимеры, белки, целлюлоза). Такие молекулы называются макромолекулами.
Как известно, химия изучает процессы превращения молекул при взаимодействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного поля), во время которых образуются новые химические связи. Под химической связью понимается результат взаимодействия между атомами, выражающийся в создании определенной конфигурации атомов, отличающих один тип молекулы от другого.
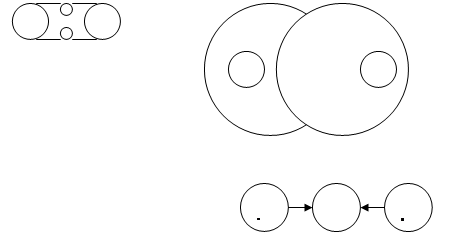
Рис. 1а «Ионная вязь» Рис. 1б «Ковалентная связь»
В молекуле выделяют два основных типа связей: ионную и ковалентную, а также водородную.
При ионной
связи один атом отдает другому один или несколько электронов, и так каждый атом становится обладателем стабильного числа электронов. Например, у атома хлора для стабильности недостает одного электрона, а у атома натрия во внешней оболочке - только один электрон. Его принимает атом хлора, и тогда у натрия протонов становится больше, чем электронов. Атомы натрия и хлора, превратившись в положительно и отрицательно заряженные ионы, притягиваются друг к другу и образуют поваренную соль.
При ковалентной
связи двух атомов возникает обобществленная пара электронов, по одному от каждого атома (пример – молекула водорода). Оба атома притягивают эту пару электронов с одинаковой силой, и электроны (или электронное облако) находятся большее время между ними. Если ковалентная связь образуется между атомами разных элементов, то электронное облако оказывается смещенным, т.е. большее время находится ближе к более притягивающему атому. Такую связь называют полярной, или электрически несимметричной (в последнем случае одна приближается к ионной).
Водородная
связь названа так из-за атома водорода, который соединен ковалентной связью с другим атомом (например, кислорода или азота) так, что положительной оказывается водородная часть молекулы. Этот частично положительный водородный «край» притягивается третьим, отрицательно заряженным атомом (опять же кислорода или азота). Эта связь слабее, чем две предыдущие, но широко распространена в живой материи. Практически, можно сказать, что на ней держится мир живого.
Силы взаимодействия между атомами являются короткодействующими (радиус действия r ~10-9 м, размер атома ~ 10-10м). Причем одновременно действуют как силы притяжения, так и силы отталкивания, но они по-разному зависят от расстояния. При r = r0 – состояние устойчивого равновесия, на этом расстоянии и находятся атомы, образующие молекулу. Если увеличить r - увеличиваются силы притяжения и возвращают систему в исходное состояние. При r < r0 силы отталкивания также возвращают систему в состояние устойчивого равновесия.
Химические связи можно рассматривать с точки зрения превращения энергии: если при создании молекулы ее энергия меньше, чем сумма энергий составляющих ее атомов, то она может существовать, т.е. ее связь устойчива. Устойчивым считается состояние, в котором потенциальная энергия минимальна, поэтому при образовании молекулы атомы находятся в потенциальной яме, совершая небольшие тепловые колебания около положения равновесия (см. рис.2). Расстояние от вертикальной оси до дна ямы соответствует равновесию – на этом расстоянии находились бы молекулы, если бы прекратилось тепловое движение. Точки левее дна соответствуют отталкиванию, правые – притяжению. Крутизна кривой выражает силу взаимодействия между атомами: чем круче кривая, тем больше сила взаимодействия.
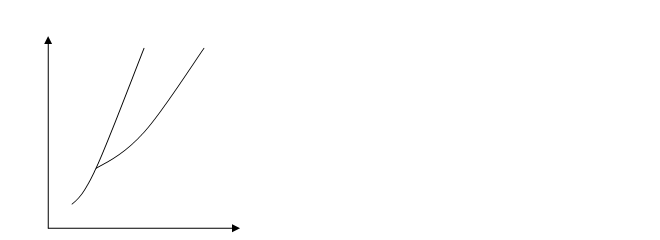
Для разных пар атомов различны не только расстояния от вертикальной оси до дна ямы, но и глубина ям. Действительно, для того, чтобы выбраться из ямы, нужна энергия, соответствующая глубине ямы. Поэтому глубину ямы можно назвать энергией связи частиц, или энергией ассоциации. Энергия, необходимая для разложения молекулы на атомы, называется энергией диссоциации. Она равна энергии ассоциации.
Это интересно:
Филогенетические отношения
Вторым, не столь прямым источником данных служит анализ морфологических сходств и различий современных насекомых, позволяющий установить филогенетические отношения. При таком анализе ищут примитивные черты в строении насекомых и пытаются ...
Практическое использование ДГГЭ
Приведенные здесь схемы ДГГЭ обеспечивают более высокую разрешающую способность и эффективность обнаружения мутаций за счет использования гетеродуплексов. Их основные этапы приведены на рис. 4. Исследуемые препараты ДНК отжигают с меченым ...
Пиленгас как интродуцент Азово-Черноморского бассейна
Акклиматизированная дальневосточная кефаль-пиленгас в настоящее время является одним из наиболее перспективных, ценных для украинского промысла объектов, дающий возможность успешно развиваться экономике страны. Пиленгас хорошо адаптировал ...

